過渡金屬氧化物納米材料(過渡金屬氧化物納米材料,TMOs)在腫瘤治療中產生活性氧(ROS)和調節腫瘤微環境(TME)。但單峰處理和生物酶的不親和性都阻礙了治療效果。在此,我們開發了一種基于TMO的多模式的一體化納米平臺,利用殼聚糖作為化學交聯劑,將超薄Ti
3C
2納米片連接到自組裝的MnFe
2O
4納米顆粒上,構建界面肖特基結Ti
3C
2@Chitosan-MnFe
2O
4 (TC@Ch-MFO),實現了更好的ROS生成并優化的生物相容性。該異質結可控制催化過氧化氫(H
2O
2)生成O
2,并消耗缺氧TME中過表達的谷胱甘肽(GSH)水平,在近紅外激發下通過環化芬頓反應實現化學動力學治療(CDT)。TC@Ch-MFO還通過引入可用于光熱療法(PTT)的高效光熱劑(PTA) Ti
3C
2構建了多模式治療納米平臺。此外,它同時集成了可視化與T
1-和T
2-加權磁共振成像(MRI)。TC@Ch-MFO對正常組織細胞的毒性可以忽略不計。該平臺可以為生物應用的多模協同納米平臺的開發提供新的思路,特別是打破了MXenes僅作為光熱劑的桎梏,將其用于生物成像傳感器和載藥。
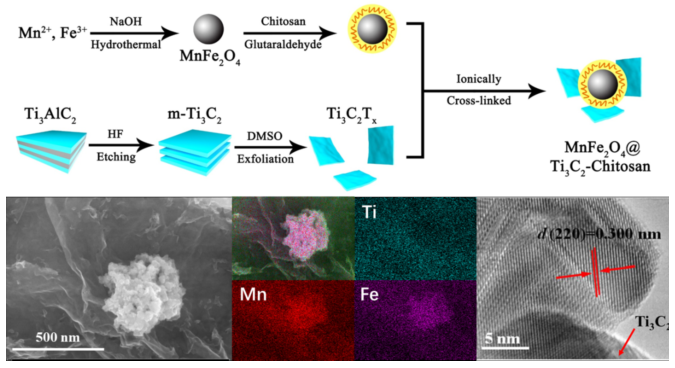
圖1 TC@Ch-MFO的合成方法及外觀形態。(a)異質結示意圖。 (b) TC@Ch-MFO的FE-SEM圖譜。橫向圖像采用原位能譜儀(EDS)成像。(c) TC@Ch-MFO的HRTEM圖像。
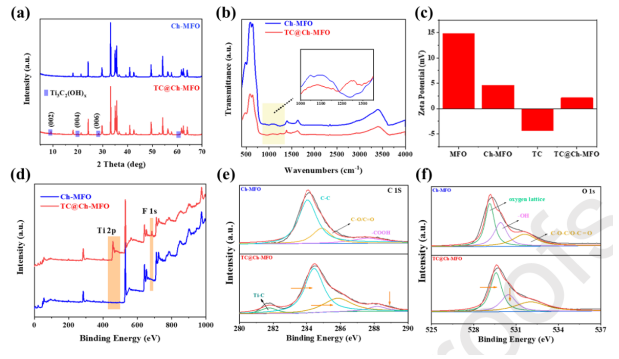
圖2元素的內部結構和化合價。(a) Ch-MFO和TC@ Ch-MFO的粉末XRD圖譜。 (b) Ch-MFO和TC@ Ch-MFO在400 ~ 4000 cm
-1范圍內的FT-IR光譜。(c) MFO、Ch-MFO、Ti
3C
2和TC@Ch-MFO的Zeta電位。(d) Ch-MFO和TC@ Ch-MFO的XPS測量。(e) Ch-MFO和TC@ Ch-MFO的C 1s和(f) O 1s高分辨率XPS譜,并擬合曲線。
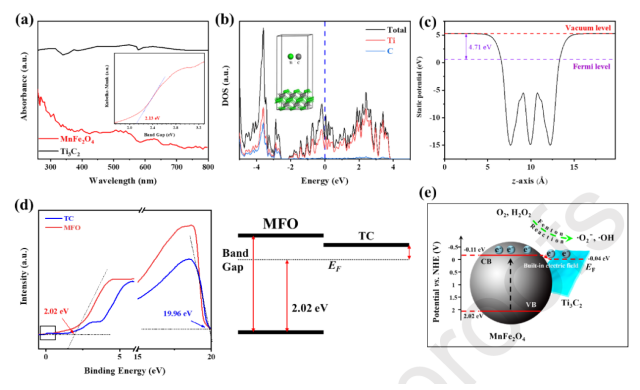
圖3 能帶結構及相應的導電帶和價帶。(a) Ti
3C
2和MnFe
2O
4的紫外-可見DRS光譜。 (b) Ti
3C
2的部分C2p、Ti 3d和總態密度(DOS)。 (c)計算出Ti
3C
2的靜電勢。(d) Ti
3C
2和MnFe
2O
4的UPS光譜的低和高動能區。(e)內置電場誘導的Schottkyjunction增強TC@Ch-MFO的ROS生成活性機制。
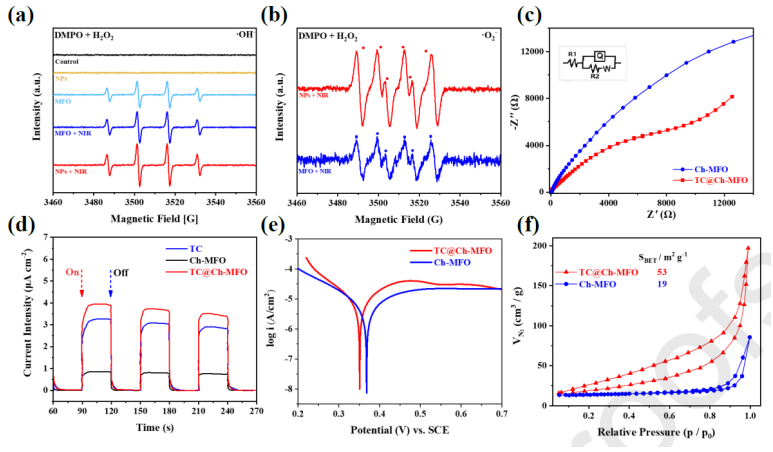
圖4. 樣品的光電性能。DMPO自旋捕獲分析結果可用于(a)檢測DMPO·OH-的水溶液和(b)檢測DMPO·O
2-的甲醇溶液。(c)所有制備樣品的Nyquist圖。 (d)樣品的光電流曲線。(e) Ch-MFO和TC@Ch-MFO的Tafel腐蝕曲線。(f)氮氣吸附解吸等溫線。
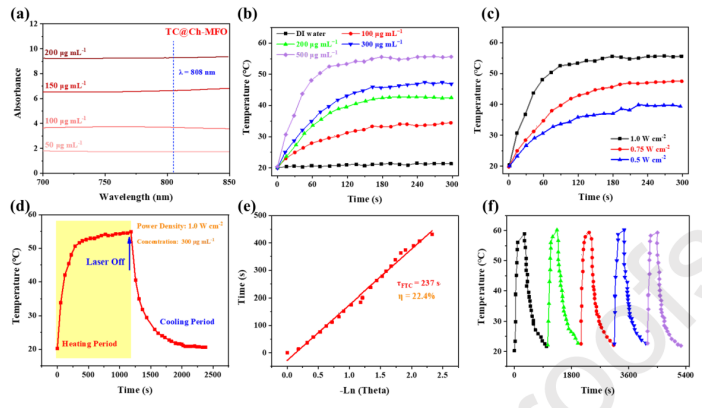
圖5 光熱性能表征。(a) TC@Ch-MFO分散在不同濃度的水中的紫外-可見-近紅外吸收光譜。(b) TC@Ch-MFO-dispersed懸浮液在不同濃度下的光熱加熱曲線。(c) TC@Ch-MFO在不同輻照功率下的光熱加熱曲線。(d) TC@Ch-MFO的水分散體在輻照下的光熱效應,輻照持續1200 s,然后關閉激光器。(e)利用冷卻周期的線性時間數據與驅動力溫度的負自然對數來計算系統換熱的時間常數。(f)回收TC@Ch-MFO的加熱型材。
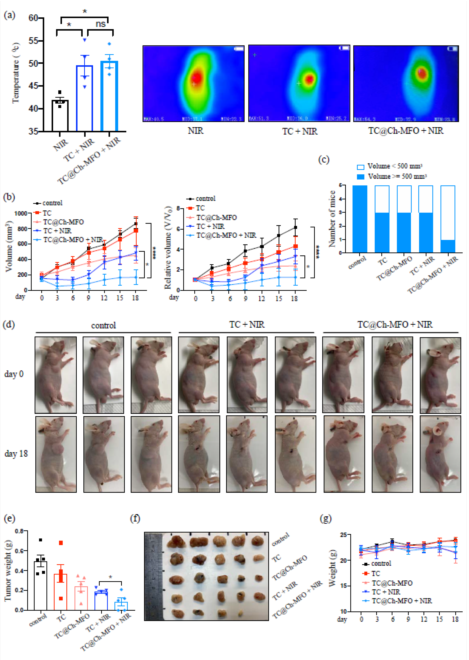
圖6 Ti
3C
2與TC@Ch-MFO抗小鼠腫瘤作用及比較。(a)用紅外攝像機記錄各組小鼠的最大光熱溫度,并采用單因素方差分析進行統計分析。(b)各組小鼠腫瘤體積每3天測量一次,采用雙因素方差分析進行統計學分析(左)。用腫瘤體積除以第0天測量的體積計算相對體積(右)。(c)第18天腫瘤大于或等于500 mm
3的小鼠數量。(d)第0天(治療當天)和第18天(處死當天)拍攝的小鼠照片。(e) TC + NIR組和TC@Ch- MFO + NIR組第18天腫瘤組織重量采用t檢驗進行統計學分析。(f)腫瘤組織宏圖。(g)每3天稱重一次。
相關科研成果由南京大學Hong-Ling Cai和Xiaoping Zou等人于2021年發表在Carbon(https://doi.org/10.1016/j.cej.2021.131925)上。原文:Self-assembled MXene-Based Schottky-Junction upon Transition Metal Oxide for Regulated Tumor Microenvironment and Enhanced CDT/PTT/MRI activated by NIR Irradiation。
轉自《石墨烯雜志》公眾號
.jpg)







.jpg)


